שרודר במעבדה בטכניון. "אני מאמין שאני עושה תיקון עולם, אבל לא במובן הדתי, אלא הערכי. מנסה לעזור לטבע במקומות שבהם הוא חסר". צילום: אלעד גרשגורן

מפצח סרטנים
יוגב כרמל
להציל שרימפס ולרפא סרטן. בעזרת השם
בגיל 43, פרופ' אבי שרודר הוא פנומן עם ארבעה סטארט־אפים שיצאו ממעבדתו ועתידים לחולל מהפכות במיגור סרטן: מריפוי באמצעות חלבון פילים עד התאמת כימותרפיה עם ננו־חלקיקים. עד שיצליח במשימת חייו, טוויסט בעלילה שלח דווקא את בוגר ישיבת עלי להציל את תעשיית השרימפס ממגפה קטלנית. והוא מצליח
המעבדה של פרופ' אבי שרודר בטכניון קטנטנה, אך הומה אדם. צוות של כ־30 איש מצטופף כאן, וכולל חוקרים מתחומי הביולוגיה והכימיה, רופאים, רוקחים ואפילו מהנדסי מכונות. המעבדה אמנם פועלת במחלקה להנדסה כימית, אך החוקרים נבחרו בקפידה ממחלקות הטכניון השונות כדי לשרת את האופי הבינתחומי של המעבדה של שרודר. מהמבחנות הקטנות שבידיהם מתוכננות לצאת יום אחד תרופות שיצילו חיים, באמצעות פתרונות ננו־טכנולוגיים לריפוי שורת מחלות. עד שזה יקרה, המעבדה השוקקת כבר הולידה חידושים ופיתוחים, שהפכו ליזמויות עסקיות. שרודר ואנשיו מעורבים בלא פחות מארבעה מיזמים מבוססי פריצות דרך רפואיות, משימוש בחלבונים של פילים לריפוי סרטן בבני אדם ועד ניצול של מערכות הולכה ביולוגיות לטיפול בלסתות תקועות.
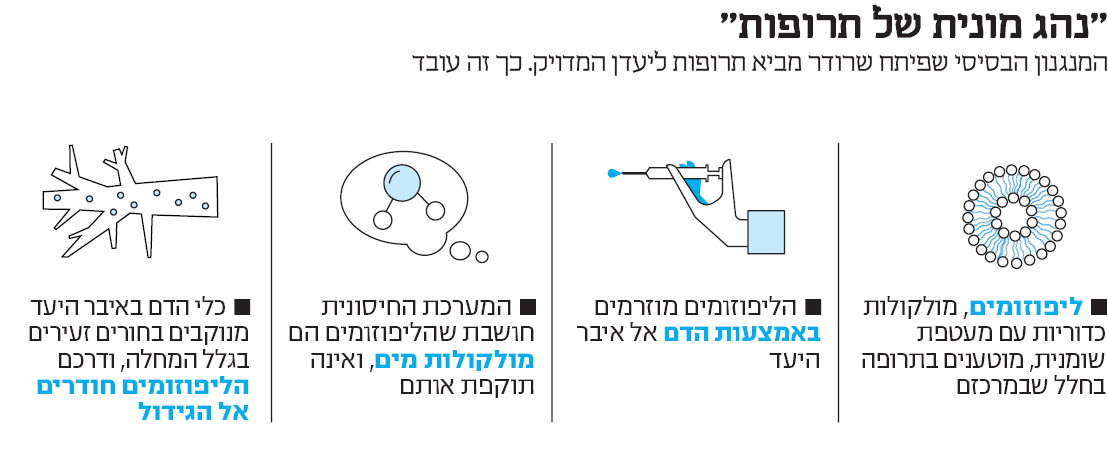
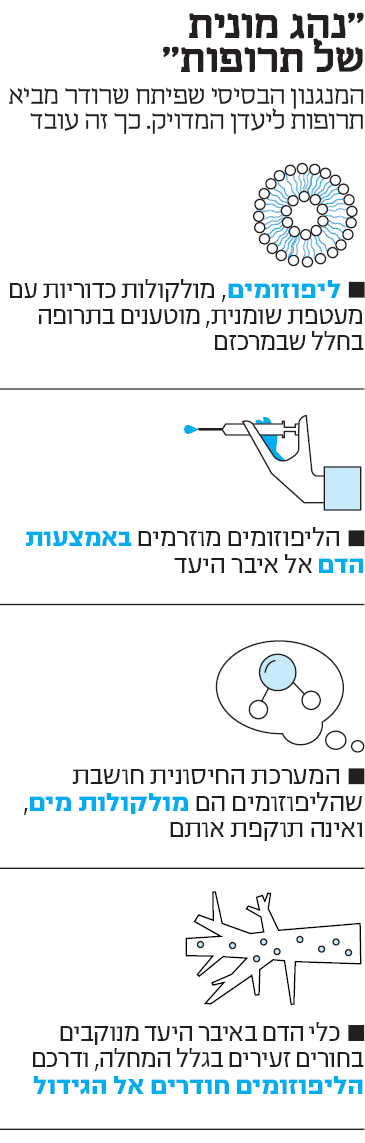
שרודר עובד עם ליפוזומים, ננו־חלקיקים שאותם מטעינים בתרופה ומזרימים בדם היישר לאיבר היעד. "אני כמו נהג אוּבּר", הוא אומר. "אבל כזה שמוציא את המזוודות וגם מניח אותן בדיוק היכן שצריך"
בגיל 43, שרודר נחשב ילד־פלא של עולם המחקר המדעי. את הדוקטורט בהנדסה כימית השלים כשהיה רק בן 33, משם המשיך לפוסט־דוקטורט ב־MIT, ובגיל 36 כבר נהפך לאחד הפרופסורים הצעירים בארץ. לפני שבע שנים הקים בטכניון את אחת המעבדות הבולטות בארץ לשילוב פתרונות ננו־טכנולוגיים ברפואה. הצעצועים העיקריים שבהם הוא משחק נקראים "ליפוזומים", ננו־חלקיקים שגודלם קטן מגודלו הסטנדרטי של תא בגוף האדם. הרעיון הבסיסי, בהפשטה רבה, הוא הטענת תרופה על הליפוזומים, כדי שיזרימו אותה ישירות לאיבר שבו נדרש הטיפול (ראו מסגרת). "כששואלים אותי מה אני עושה, אני מספר לאנשים שהמקצוע שלי הוא נהג אוּבּר", אומר שרודר. "אבל אני לא סתם נהג שרק מוריד את הנוסע ביעד, אני גם דואג להוציא את המזוודות ולהניח אותן בדיוק איפה שצריך".
משימת חייו של שרודר היא לקדם את הטיפול בסרטן באמצעות ליפוזומים. זה עדיין לא קרה, אבל הפיתוחים שלו זימנו טוויסט מפתיע לחוקר חובש הכיפה, בוגר הישיבה התיכונית באפרת והמכינה הקדם־צבאית היוקרתית "בני דוד" בעלי: שרודר עסוק בשנים האחרונות בריפוי שרימפס.
מכל האורגניזמים שבעולם, בחרת להציל שרץ לא כשר?
"לאמא שלי הסברתי בהתחלה שאני עובד על טיפול לסרטן. לא אמרתי לה שמדובר בסרטן מהסוג שמגיע מהים", הוא אומר בחיוך. "אני מגדיר את עצמי כדתי ליברלי, אין לי רב ולא אכפת לי מה קורה אצל אנשים אחרים בצלחת. הדבר החשוב מבחינתי הוא שאני עוסק בהצלת מקור מזון שחיוני מאוד לאנשים רבים. כמעט כל מיליארד הסינים אוכלים שרימפס לארוחת בוקר. אז נכון שהחבר'ה פה יורדים עליי לפעמים שאני לא יודע כמה זה טעים ומה אני מפסיד, אבל אותי זה ממש לא מעניין".
"אני מרגיש, וזה נתמך בנתונים מחקריים, שבתוך עשור נפתור את מרבית הבעיות הקשורות בטיפול בסרטן. כל הפיתוחים בתחום מתכנסים לטיפולים מותאמים אישית, וב־2030 רוב החולים יוכלו להירפא"
השידוך בין שרודר לשרימפס נולד במקרה, ומבוסס גם הוא על ההתמחות של שרודר בשינוע תרופות. "לפני שש שנים נתתי הרצאה בפרוטליקס, חברת ביוטכנולוגיה בכרמיאל", הוא מספר. התוכן הלהיב את ד"ר שי אופז, אז עובד פרוטליקס והיום שותפו העסקי של שרודר. "בחברת חקלאות ימית שעבדתי בה קודם הכרתי את היקף הנזק שמגדלי שרימפס בכל העולם נאלצים להתמודד איתו", אומר . "פתאום הבנתי שאולי הכיוון שאבי מציע יכול לסגור את הפינה".
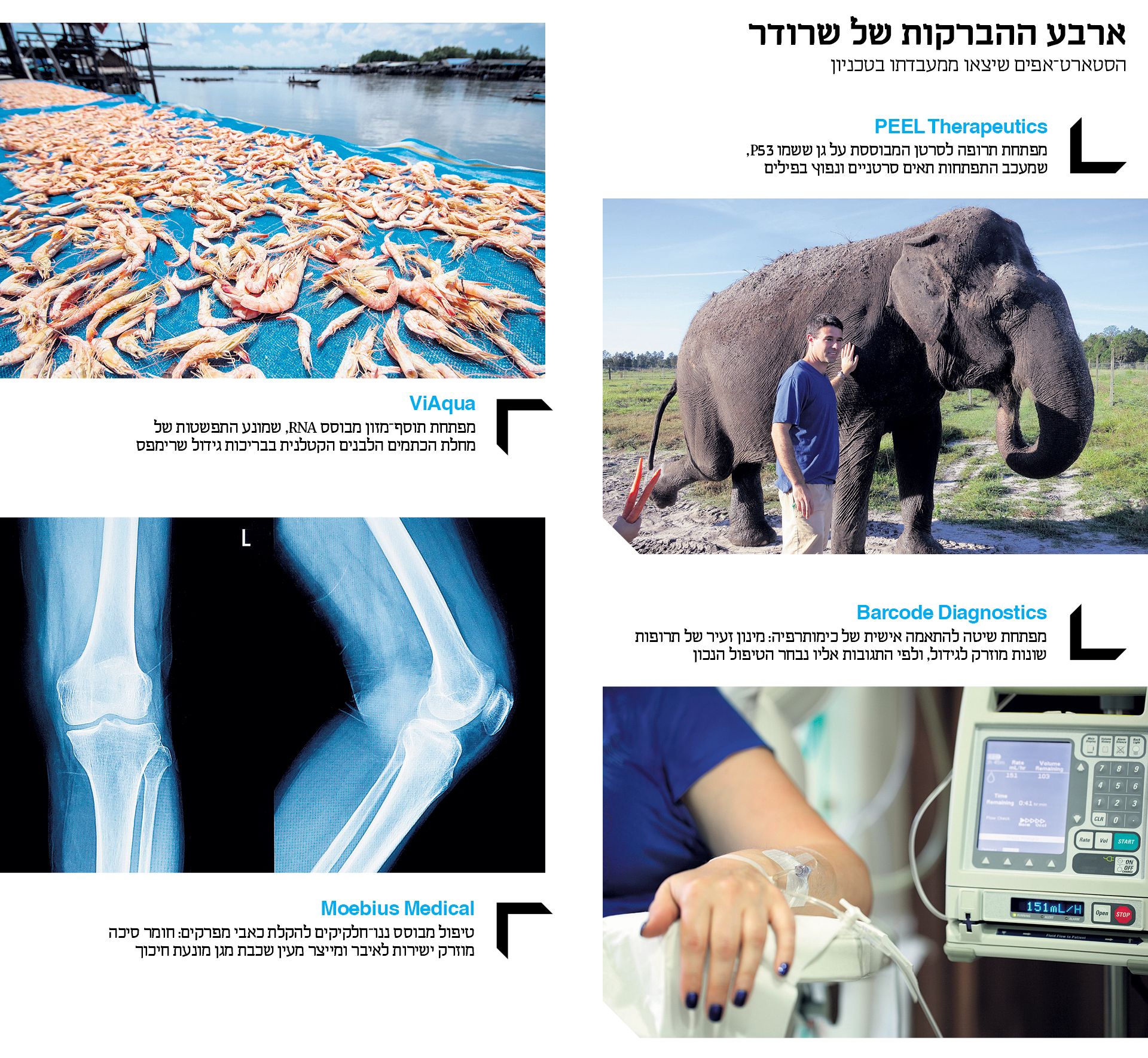
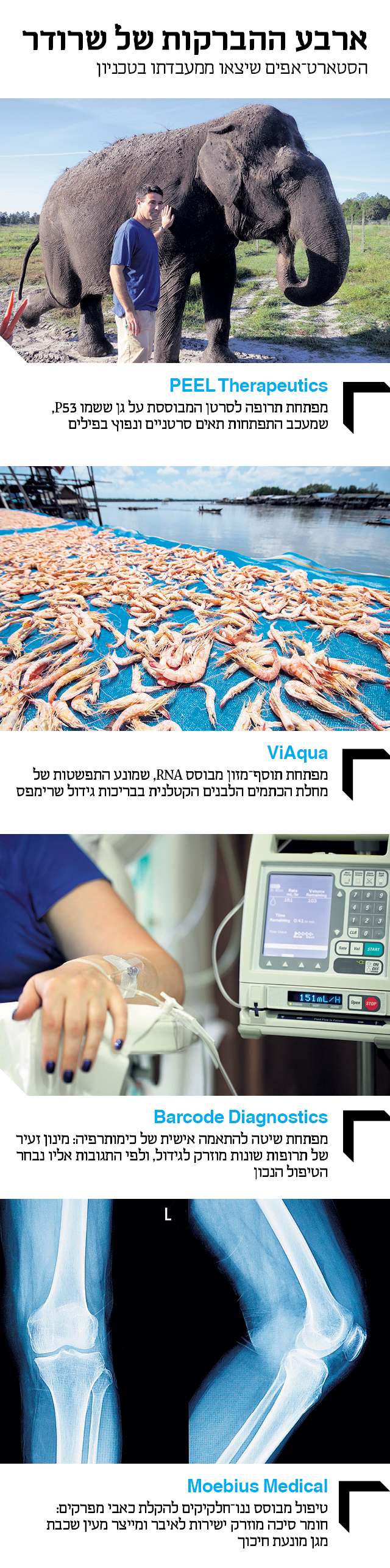
"הפינה" היא מחלת הכתמים הלבנים (White Spot Syndrome), שמחסלת כבר שנים רבות בריכות שלמות של שרימפס ומכה בעיקר במזרח אסיה, שם מרוכזת מרבית תעשיית הגידול. שיעור התמותה בבריכה שנדבקה במחלה גבוה מ־80%, וברוב המקרים זמנו של שרימפ נגוע קצוב בשעות. זה שנים שמחלת הכתמים הלבנים מכה קשות בתעשייה שמגלגלת יותר מ־30 מיליארד דולר בשנה, וההקפדה הרופפת על הסניטציה בבריכות אפשרה לנגיף לשגשג ולפלוש גם לאזורים נוספים של העולם. עד כה מרבית הניסיונות למיגורו התמקדו בשיפור התברואה ודילול כמות השרימפס. אלה השיגו שליטה מסוימת בממדי המגפה, אך היקף הנזק עדיין דרמטי.
"שבוע לאחר ההרצאה נפגשנו ליד הבית שלי בבנימינה", ממשיך שרודר את הרשומון. "אופז ושי איינבינדר (שגם הוא הפך שותף) סיפרו על בעיה שהם מחפשים לה פתרון. הרגשתי שהם נוגעים ולא־נוגעים בבעיה, לא הצלחתי להבין מה הם אומרים. הם סיפרו משהו בסגנון 'שמע, בעולם החקלאות הימית יש הרבה מאוד מחלות, בדגים, וגם בעוד חיות'... היה ניכר שהם קצת מתביישים לומר באיזו חיה בדיוק מדובר. בסוף הבנתי שהכיפה על הראש שלי גרמה להם להרגיש לא נעים לגלות שמדובר בתכשיר שמיועד לשרימפס".
"לאמא שלי הסברתי שאני עובד על טיפול לסרטן. לא אמרתי לה שמדובר בסוג שמגיע מהים. אני דתי ליברלי. לא אכפת לי מה קורה לאחרים בצלחת. מבחינתי אני מציל מקור מזון חשוב"
כל הצדדים התגברו במהירות על אי־הנעימות, וב־2014 הקימו שרודר, אופז ואיינבינדר את ViAqua, כדי לפתח תרופה למחלת הכתמים הלבנים, שלפי נתוני ויאקווה, הנזק המצטבר שהיא גורמת נאמד ב־6 מיליארד דולר בשנה. הדרך לפתרון עוברת בביתן קטן בקצה הטכניון, שממנו עולה ריח חריף שמזכיר את חנויות הדגים של נמל יפו. בתוך כמה עשרות אקווריומים קטנים שמשקיפים אל מפרץ חיפה מחכים אלפי חסילוני הניסוי של ויאקווה לארוחת הצהריים שלהם. בכדוריות המזון הקטנות שמוענקות להם מוחבא תוסף מזון שאמור לחסן מפני הנגיף. "יצרנו חומר שבנוי מחומרים שדומים לחומרי המזון הרגילים של השרימפס, ולכן המוצר מוגדר תוסף מזון ולא תרופה", מבהיר אופז. "אנחנו רוצים לתפוס את השרימפס כשהם עוד קטנים, ולחסן אותם מהמחלה לפני שתהיה להם הזדמנות לחלות בה".
בביתן הקטן נערך רק ניסוי הבסיס של החברה, על פורמולת המזון שממנה מורכבים מוליכי הטיפול. מכיוון שישראל אוסרת הכנסה של נגיף הכתמים הלבנים לארץ, אפילו לצורכי מחקר, מתקיים המחקר הקליני של ויאקווה בשלושה אתרים באירופה, באסיה ובארצות הברית. לפי נתוני החברה, שיעור התמותה של שרימפס שקיבלו את החיסון שלה צנח ביותר מ־50% לעומת קבוצת הביקורת.
הפיתוח של ויאקווה מבוסס על RNAi. ב־1998 גילו החוקרים האמריקאים אנדרו פייר וקרייג מלו כי מולקולות ה־RNA, שאחראיות לייצור החלבונים שבונים את תאי הגוף, יכולות תחת תנאים מסוימים לחדול מפעולתן. הגילוי הזה, שקיבל את השם RNAi, זיכה את מגליו בפרס נובל לרפואה והצית את דמיונם של חוקרים רבים, בהם גם שרודר. "ב־2012 הגעתי ל־MIT לעשות פוסט־דוקטורט", הוא מספר. "זו היתה תקופה שבה גילוי מנגנון ה־RNAi עוד היה חדש לגמרי והיה עיסוק נרחב ברתימה שלו ליישומים הקשורים בסרטן, כמו מניעת גרורות".
איך?
"למשל, כשתאים סרטניים יוצאים מהגידול הראשוני ופולשים לריאה, הם זקוקים לחלבון שיקשר אותם לרקמת הריאה. ראינו שאפשר לעכב את ייצור אותו חלבון, ואז יש פחות גרורות. אנחנו יודעים לסנתז מולקולה שנקראתsiRNA, שיודעת להחליף את ה־RNA המקורי של הגוף. אפשר לייצר מולקולה כזאת עם רצף מסוים שיעצור תאים מלהידבק ולהיהפך לגרורתיים, ומולקולה כזאת עם רצף אחר תהפוך את התא לרגיש יותר בפני תרופות".
איך לוקחים טיפול שמיועד לסרטן בבני אדם והופכים אותו לטיפול בשרימפס?
"המנגנון הביולוגי בשרימפ ובאדם, כמו בכל יצור חי, הוא דומה. כדי שהנגיף יעבור מתא לתא בשרימפ הוא זקוק לחלבונים מסוימים, שאת ייצורם אנחנו יודעים כיום כיצד לעצור".
הפיתוח של ויאקווה נמצא כעת בתהליכי אישור רגולטורי ב־11 מדינות שונות. אם הכל ילך כמתוכנן, כבר ב־2020 הוא יֵצא לשוק. החברה, שצופה מכירות של חמישה מיליון יורו בשנה הראשונה, חתמה לאחרונה על הסכם בלעדיות עם נוטרקו ההולנדית, שהיא מהחברות המובילות בעולם בייצור מזון לחקלאות, שאף נכנסה כשותפה בוויאקווה. שותפות נוספות הן החממה הטכנולוגית טרנדליינס ממשגב, קרן ההון סיכון הסינגפורית VisVires והטכניון.
הלסת הנעולה שפתחה מיזם
אבל הרבה לפני הכתמים הלבנים של השרימפס היה הסרטן. המפגש הראשון של שרודר עם המאבק במחלה היה עוד בימי התואר הראשון בהנדסת כימיה באוניברסיטת בן גוריון בתחילת העשור הקודם. שרודר היה אז עובד זוטר בטבע שחלם על קריירה כמהנדס בתעשיית התרופות. רצה הגורל והוא נשלח לסייע במעבדתו של פרופ' חזי ברנהולץ, מחלוצי שילוב הננו־טכנולוגיה ברפואה והממציא של דוקסיל, תרופה כימותרפית לטיפול בסרטן השד.
ברנהולץ עמל אז על פיתוח טכנולוגיה להולכה בטוחה של תרופות כימותרפיות על ידי ליפוזומים, המתוכנתים לאתר ולתקוף ישירות את הגידול הסרטני ובכך למקד את הטיפול אגב דילוג על השלב המייסר של תופעות הלוואי. הפרויקט ההוא לא הצליח לבסוף להבשיל מסחרית, אבל המפגש עם היכולות הננו־טכנולוגיות המתקדמות והאפשרות להקל באמצעותן על חולי סרטן שינו את מסלול חייו. "נפתחה מסגרת של שיתוף פעולה בין אוניברסיטת בן גוריון לעברית ורצו לשלוח סטודנט שיסייע לפרופ' ברנהולץ במחקר. היתה אמורה לנסוע סטודנטית אחרת שוויתרה, אז בחרו בי. לא היתה לי שום כוונה להמשיך לקריירה אקדמית, רק רציתי לייצר תרופות, אבל כשהבנתי על אילו דברים עובדים במחקר, הבנתי שהמקום שלי הוא המחקר ולא התעשייה. הסטודנטית ההיא היום בכירה בטבע".
המחקר הראשון של שרודר על ליפוזומים נעשה בילדים חולי סרטן. "לקבל זריקה זה לא נעים לאף אחד, אבל כשמדובר בילדים שמטופלים בכימותרפיה ומקבלים זריקות כל הזמן, העניין נהיה קשה עוד יותר. כדי לחסוך מהילדים האלה את הכאב נותנים להורים חומר מאלחש שאותו הם אמורים למרוח על העור של הילד עוד לפני שיוצאים מהבית לבית החולים, כדי לאפשר לחומר זמן להתחיל לפעול, אבל לפעמים יש פקקים בדרך או שכבר מגיעים לבית החולים והצוות עסוק בטיפול במטופלים אחרים ואז האלחוש כבר לא אפקטיבי. כדי להתגבר על הליקוי הזה עבדנו על פיתוח מערכת שתוביל את החומר המאלחש אל אזור הזריקה במהירות ויעילות באמצעות גלי אולטרסאונד שמוקרנים לגוף ומשחררים את החומר באזור המדויק. הפיתוח של המערכת למעשה כבר הושלם, אבל חברות התרופות לא ידעו איך לעבוד מול החברות שעוסקות באולטרסאונד ובסוף הפרויקט החשוב הזה לא הגיע לשוק בגלל כשלים כלכליים".
מתסכל.
"הפרויקט לא נכשל כמו שהוא הקדים את זמנו. לראיה, היום מפותחים פתרונות דומים מאוד למה שעשינו אז. ב־2007, כשפרסמתי את המחקר, היתה התלהבות גדולה והמאמר צוטט יותר מאלף פעמים, שזה הרבה מאוד בעולם המדעי, אבל לקח זמן לעולם המדעי להסתנכרן עם העולם הטכנולוגי והעסקי. כשבאנו אז לחברות תרופות והראינו שהפיתוח פועל, אמרו לנו 'זה נחמד, אבל אנחנו לא מתעסקים עם אולטרסאונד', וחברות של מערכות אולטרסאונד אמרו 'זה נחמד, אבל אנחנו לא מוכרים תרופות'. כיום רבות מהתרופות החדשות משלבות בין מערכת טכנולוגית לבין תרופה".
השלב הבא, כמו הרבה ציוני דרך חשובים בקריירה של שרודר, הגיע ממש במקרה. "כשהייתי דוקטורנט באוניברסיטה העברית ב־2006 קיבלנו פנייה מבית חולים הדסה בעקבות מקרה של ילדה שננעלה לה הלסת. הם ביקשו לראות איך ניתן לגייס את טכנולוגיית הליפוזומים לטובת הטיפול בה, אז לקחנו ליפוזומים ריקים, שיחקנו עם ההרכב המולקולרי שלהם, והצלחנו להפוך אותם לחומר סיכה, כמו גריז במיסבים של של מכונה".
הניסוי המוצלח על הלסת של אותה ילדה התגלגל בתוך שנתיים להקמת החברה Moebius Medical, מיזם משותף לטכניון, האוניברסיטה העברית והדסה, שפיתח את חומר הסיכה מבוסס הליפוזומים לכדי תכשיר מסחרי שיוזרק ישירות למפרקיהם של חולי דלקת פרקים ויקל את כאביהם. ב־2016 מכרה מוביוס את הזכויות על המוצר ל"סאן פארמה" ההודית, מחברות התרופות הגנריות הגדולות בעולם, בהסכם שיתוף פעולה שנאמד ביותר מ־10 מיליון דולר.
תשע שנים לאחר אותה לסת גורלית, היתה זו ילדה קטנה אחרת שהביאה להקמת המיזם הבא של שרודר. "פנו אלינו מביה"ח רמב"ם, שם היתה תינוקת עם גידול נדיר בראש, והרופאים התלבטו באיזו תרופה לעשות שימוש", הוא נזכר. "במקרים אחרים עושים כמה בדיקות עד שמוצאים את התרופה הנכונה, אבל טעות בטיפול בתינוקת כל כך קטנה עם גידול במוח יכולה להיות קריטית. אז בשיתוף פעולה איתם נרתמנו ליצירה של מערכת בדיקה שקצת מזכירה בדיקת אלרגיה. כשבודקים אלרגיות מזריקים מינון קטן מאוד של חומר אלרגני וממתינים לתגובה שמופיעה או לא מופיעה על העור. לפי אותו עיקרון, לקחנו ליפוזומים ומילאנו כל אחד מהם בסוג אחר של תרופה כימותרפית במינון זעיר, אלפית מהמינון שמשמש לטיפול, ואותם הזרקנו לגוף הילדה. מינון כזה לא יכול לגרום לנזק, אבל הוא מספיק כדי לקבל תמונת מצב ולהבין איזו תרופה יכולה לספק את הפתרון הרצוי".
הניסוי החדשני הציל את הילדה, שקיבלה טיפול נכון ונרפאה לחלוטין. ובעקבות ההצלחה הזאת הוקמה ב־2015 חברה בשם ברקוד דיאגנוסטיקה, שמטרתה להפוך את הניסוי לשיטת טיפול נרחבת. "לפחות שליש מחולי הסרטן לא מקבלים תרופה שמתאימה להם וקשה מאוד לחזות כיצד התרופה תגיב בגוף החולה", מסביר שרודר. "הטכנולוגיה שלנו מאפשרת להתאים טוב יותר את הטיפול לכל חולה וחולת סרטן. אנחנו מפתחים היום כלי שמאפשר לרופאים בתוך 48 שעות לכל היותר לקבל אינדיקציה ברורה איזו תרופה עובדת ואיזו לא. אחרי מספר שנים של ניסויים בבעלי חיים, ב־2020 ניכנס סוף־סוף לניסוי קליני בחולות סרטן שד".
ואם לא די בכל הפיתוחים הללו, ב־2015 הקים שרודר גם את החברה בעלת השם האירוני PEEL Therapeutics, שיתוף פעולה בין הטכניון לאוניברסיטת יוטה, שבמסגרתו בוחנים טיפול בסרטן באמצעות חלבון שנלקח מפילים. מה ששמעתם.
"לפילים אין סרטן, שזה דבר די מדהים", מסביר שרודר. "כשמסתכלים בתאים שלהם ומשווים אותם לשלנו, רואים הבדל אחד שקשור לגן שנקרא P53, ומוכר כמדכא התפתחות תאים סרטניים. הוא מתנהג כמו ניידת משטרה המתרוצצת בתוך כל תא בגוף ומוודאת שהסדר נשמר ושום סרטן לא מתפתח. אבל ככל שאנו מתבגרים, הניידת הזאת מתיישנת ומתקלקלת, ולכן סרטן נעשה שכיח יותר ככל שעולים בגיל. בני האדם נאלצים להסתפק בשני העתקים של הגן הזה, אחד מכל הורה. אבל הפילים קיבלו 40 העתקים ממנו, ובמינון גבוה שכזה הסרטן לא יכול להתפתח. יתרה מזאת, האופן שבו הגן בנוי אצל פילים הופך את ה’ניידת’ שלהם לעמידה יותר. מה שאנחנו שואפים לעשות הוא לקחת P53 מפילים ובאמצעות מערכת הולכה מבוססת ליפוזומים להוליך את הגן הפילי היישר לתוך הגידול שאותו אנחנו רוצים לחסל".

אתה מתכוון ממש להחדיר חלקיק קטן של פיל לתוך חולי סרטן?
"לא, את החלבון אנחנו מייצרים מלאכותית במעבדה. אבל העותק הראשון, שממנו שוכפלו ההעתקים האחרים, פותח באמצעות דגימת דם של פיל שקיבלנו מגן חיות בארצות הברית".
איפה עומד הפיתוח הזה?
"אנחנו בשלב הפרה־קליני והשגנו הוכחת היתכנות ב־15 סוגי סרטן, כולל כאלו שנחשבים עמידים ביותר, כמו סרטן המוח, סרטן הלבלב וסרטן עצמות שנקרא אוסטאוסרקומה, שפוגע בעיקר בילדים. בתוך כמה שנים כבר תהיה לנו תרופה לשווק".
אוטוטו יגיע הקץ לסרטן
הסיור בטכניון הסתיים ואנחנו ניגשים לאכול ארוחת צהריים בחומוסייה שנפתחה בסמוך למוסד האקדמי. מעל צלחת חומוס, כשברקע שאון של סטודנטים הצעירים במעט משרודר, הוא מספר לי שיום עבודה סטנדרטי שלו נמשך כ־18 שעות: "אני משתדל לעשות חלק מהעבודה מהבית, בשביל המשפחה".
שרודר חי בבנימינה עם אשתו וחמשת ילדיהם, אך חלק עצום מהזמן שלו עובר במטוסים, כיאה לאדם שמעורב בניהול של ארבע חברות חוצות יבשות. בחודש שקדם לפגישתנו הוא הספיק לבצע שתי גיחות קצרות לארצות הברית ועוד ביקור לא מתוכנן בהודו. בשלב מסוים של השיחה הוא שולף מהתיק את הדרכון שלו, עוד לא בן שנתיים וכבר מתפקע מחתימות של מדינות מכמעט כל יבשת אפשרית. עכשיו בזכות חופשת חג המולד, הוא מספר, יהיה לו סוף־סוף קצת זמן מנוחה בארץ.
אתה ממוקד כיום בטיפול בשרימפס אבל המטרה שלך היא עדיין למגר את הסרטן?

"בהחלט. פשוט כיום אני כבר מבין שזה ייקח יותר זמן מכפי שחשבתי, ודאי יותר מכפי שייקח לנו הפיתוח בשרימפס.
"בשרימפ יש רק חלבון אחד שאחראי להפצת הנגיף, ואנחנו יכולים לתקוף אותו בקלות. בתאים הסרטניים, לעומת זאת, המנגנונים מורכבים הרבה יותר כי בזמן שחלבון אחד 'מטופל', חלבון אחר יכול לעשות את אותה הפעולה. אבל אנחנו עדיין נמשיך במאמצים לפתח תרופה מבוססת RNA לטיפול בסרטן".
איך אתה רואה את העתיד בכל הקשור לטיפול בסרטן?
"אני מרגיש, וזה נתמך בנתונים מחקריים, שבעשור הקרוב אנחנו נפתור את מרבית הבעיות הקשורות בטיפול בסרטן. ב־2030 נגיע למצב שרוב חולי הסרטן יירפאו מהמחלה. כל הפיתוחים בתחום מתכנסים לטיפולים מותאמים אישית, עם יכולת הובלה מקסימלית של הטיפול, שתאפשר צמצום דרמטי של תופעות לוואי מכימותרפיה".
כאדם דתי, אתה רואה את עצמך כמתקן עולם במובן היהודי של הביטוי?
"אני בהחלט משתדל. זה אחד היעדים שלנו כמעבדה, אבל לא במובן הדתי, אלא במובן הערכי. אני לומד פעמים רבות מהטבע, ומנסה ליישם במקומות שהטבע חסר, לעזור לו".
יש מי שיראו בזה סתירה של עבודת הבורא.
"להפך, העולם נהדר, אך לא מושלם. עלינו מוטלת האחריות לשמור על הקיים ולשפר את מה שחסר".