שבב קטן, צעד גדול
רוני דורי
צילום: אלכס קולומויסקי
שבב של תקווה
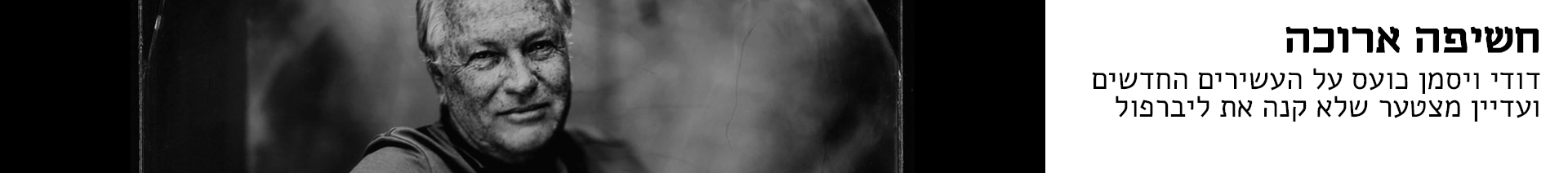
אליענה שטיינברג היתה רוקחת, עד שנמאס לה לראות מטופלים סובלים בלי שתוכל לעזור. היא שינתה מסלול, הפכה לחוקרת, וכעת, בגיל 28, היא חתומה על פיתוח שעשוי לחולל מהפכת ענק בטיפול במחלות, ובראשן סרטן: שבב זעיר שבוחן במהירות שיא כמה טיפולים על אותו גידול, ומפענח איזה מהם יעבוד הכי טוב


שטיינברג במעבדתה באוניברסיטה העברית. "לא רציתי רק להסביר למטופלים איך לקחת תרופה. רציתי להקל את הסבל שלהם"
להאזנה לכתבה
הוקלט על ידי הספרייה המרכזית לעיוורים ולבעלי לקויות קריאה
מוסף כלכליסט | 28.07.22
א
ליענה שטיינברג היתה רוקחת בבית מרקחת בירושלים כשנתקלה במטופל ששינה את חייה: "היה לו סרטן ערמונית בשלב מתקדם עם גרורות, והוא היה מגיע לבית המרקחת כמה פעמים בחודש. נוצרו לי קשרים אישיים איתו ועם אשתו", היא מספרת ל"מוסף כלכליסט". "היה ממש עצוב לראות מול העיניים את התקדמות החולי שלו ואת חוסר האונים, בפרט כשהוא עמד לקראת טיפולים קשים, שבכלל לא היה בטוח שיצליחו. רציתי לעזור לו פרקטית במחלה עצמה, מעבר למתן הסברים על איך לקחת את התרופות. רציתי להקל את הסבל שלו".
שטיינברג החליטה לפנות ללימודי תואר שני במסלול למצוינות בננוטכנולוגיה בבית הספר לרוקחות של האוניברסיטה העברית. מאז הלימודים התפתחו לדוקטורט, ובארבע השנים האחרונות היא פיתחה שיטה שעשויה לחולל מהפכת ענק באופן שבו מטופלים חולי סרטן: שבב שקוף, שבעזרת דגימה מזערית מגידול סרטני בוחן שורה של טיפולים אפשריים כדי לראות מי מהם הוא האפקטיבי ביותר, ובזמן שיא — התוצאות מתקבלות תוך פחות משבועיים.
"כיום אפשר לדעת אם מטופלים מגיבים לטיפול מסוים רק לאחר כמה שבועות או חודשים", מסבירה שטיינברג. "זה עצוב כי עבור חלק מהם, עד שמגיעים לשלב הזה כבר לא נשאר זמן לנסות טיפולים אחרים, והם מפספסים את ההזדמנות לקבל את הטיפול שכן היה מתאים להם. יתרה מזאת, בזמן הם מפתחים גרורות, הגוף שלהם נחלש עוד יותר מהטיפולים הכימותרפיים, ויכולתם להתמודד עם הטיפול הבא פוחתת. השיטה שלי נועדה לעקוף את המגבלה הזאת".
הפיתוח, שנעשה בהנחייתה של פרופ' עפרה בני, כבר נמצא בשימוש במטופלים אונקולוגיים מבית החולים הדסה תחת אישור ועדת הלסינקי, המאשרת ניסויים בבני אדם. בשנה הקרובה עתידה לקום חברה מסחרית על בסיס הפיתוח, עוד לפני שנכנס להליך אישור רגולטורי. בינתיים זיכה השבב את שטיינברג במלגת אדמס היוקרתית בסך 100 אלף שקל, שתוענק לה הערב. "מדובר במאות של טיפולים שאפשר לבחון בזמן קצר מאוד יחסית", מסביר פרופ' משה אורן, ביוכימאי, חוקר סרטן במכון ויצמן ויו"ר ועדת ההיגוי והבחירה של תוכנית המלגות, שמשותפת לאקדמיה הלאומית למדעים ולמשפחת אדמס הקנדית. "ברגע שתוכח יעילות הפיתוח של אליענה, ללא ספק תהיה לו השפעה מרחיקת לכת עבור חולי סרטן".
איך עובד מודל "גידול על שבב" ("Tumor On a Chip") שפיתחה שטיינברג? לוקחים פיסת רקמה בגודל כמה מילימטרים מהגידול, ומפרקים אותה במעבדה לכדי מאות תאים בודדים. בטכניקת צלחת פטרי תלת־ממדית בונים מחדש מהתאים האלה מאות "דגמים" של הרקמה המקורית, שמכילים את כל תאיה — סרטן ורקמה סובבת. מאות הרקמות המשוחזרות (שמכונות "ספרואידים") מוכנסות לשבב שבתוכו כמה תעלות, שבכל אחת מהן מועברת תרופה אחרת לרקמות. לאחר כשבוע בוחנים את תוצאות הטיפולים השונים ומסיקים איזה מהם הוא האפקטיבי ביותר נגד הגידול.
המודל שפיתחה שטיינברג שייך לענף המיקרופלואידיקה — תחום מחקר שמשלב בין הנדסה, פיזיקה, כימיה, מיקרוטכנולוגיה וביוטכנולוגיה, ועוסק בהתנהגות, בקרה ושליטה של נוזלים בממדים זעירים, בסדר גודל של מיקרונים. כך למשל, נאס"א עושה שימוש ב"מעבדה על שבב" — שבב סיליקון שבתוכו מבחנות מיניאטוריות וחיישני ניטור, שאליו מוזרמים חומרי ניסוי כמו תרביות, חיידקים וכימיקלים במיליליטרים בודדים — בין היתר כדי לסרוק דנ"א ומולקולות אורגניות בחיפוש אחר סימני חיים בחלל.
"איבר על שבב" — שבב שבתוכו גדלות רקמות של איברים שונים — הוא שלב נוסף באבולוציה של התחום, שמשלב את היתרונות של ניסויים במבחנה (in vitro) עם ניסויים בבעלי חיים (in vivo): מצד אחד, יש כאן ניסוי ברקמה חיה בלי לפגוע בבעלי חיים בתהליך שעשוי להימשך זמן רב ולהסתיים בכישלון, ומהצד האחר, תנאי המעבדה מאפשרים ניסויים בלתי מוגבלים בלי להזיק למטופלים. התקווה היא שבעתיד הטכנולוגיה הזאת תחליף חיות מעבדה בתהליכי פיתוח תרופות ובדיקת רעלנים.
"אחד הדברים שאני הכי אוהבת במחקר שלי הוא שהוא קליני מאוד, זה לא שאני חוקרת משהו אבסטרקטי ואולי בהמשך הוא יהיה משהו ישים, זה ממש תכלסי — מגיעים ורואים את התוצאות בקליניקה", אומרת שטיינברג. "האידאל מבחינתי הוא שהשבב שלי יהפוך למשהו שנגיש לציבור כחלק משגרת הטיפול בסרטן".

אבחון בקטנה
כך יעבוד השבב של שטיינברג
1
לוקחים פיסת רקמה בגודל כמה מ"מ מהגידול
2
במעבדה הרקמה מפורקת למאות תאים בודדים
3

בטכניקת צלחת פטרי תלת־ממדית בונים מחדש מהתאים מאות "דגמים" של הרקמה המקורית, שמכילים את כל תאיה — סרטן ורקמה סובבת
4
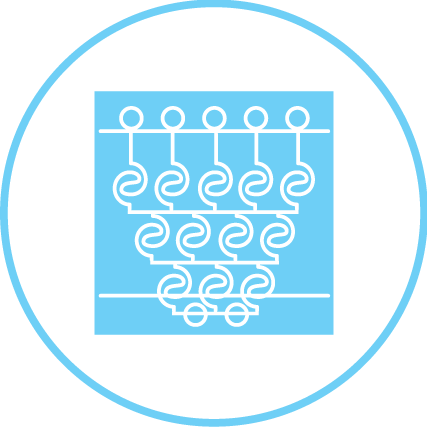
מאות הרקמות המשוחזרות (ספרואידים) מוכנסות לשבב שמודפס במדפסת תלת־ממד
5
בשבב יש תעלות, שבכל אחת מהן מועברת תרופה אחרת לרקמות. כך ניתן לבחון במקביל עשרות טיפולים
6

בתוך פחות משבועיים תוצאות הטיפולים מביאות למסקנה: איזה טיפול הוא האפקטיבי ביותר נגד הגידול
אחת שרצה ונכנסת מהחלון
הדבר המפתיע ביותר ברזומה של שטיינברג הוא גילה — רק בת 28. "יש אנשים שמגיעים לדוקטורט הרבה אחרי גיל 30, ויש כאלה שרצים, כמו אליענה", אומר עליה פרופ' אורן. שטיינברג מסייגת בחיוך כי "אני נחשבת רק קצת צעירה במעבדה, ולא באופן קיצוני".
היא נולדה במשפחה דתית, בת לזוג עולים מארצות הברית, הצעירה מתוך שישה אחים ואחיות. היא גדלה בירושלים וגרה בה גם כיום. אחרי שירות לאומי, שבו סייעה לתלמידים עם קשיי למידה ועולים חדשים, למדה תואר ראשון ברוקחות באוניברסיטה העברית, וסיימה אותו בהצטיינות.
"חשוב לי שהעבודה שלי תהיה משמעותית, ושאראה את העזרה שלי לאנשים בצורה ישירה. רציתי לשלב את התיאוריה עם המעשי", היא מספרת. "להיות רוקחת זה לרדת לשטח, הרגשתי שאני באמת רואה את המטופלים ואת הצרכים שלהם ומתחברת אליהם ברמה האישית. זה גרם לי לרצות לעזור להם עוד יותר".
אז למה לא למדת רפואה?
"פחות חיפשתי קשר ישיר עם חולים, ויותר עניין אותי לפתח טיפולים. רוקחות נראתה לי מקצוע מעניין וחשוב עם עבודה".
מה היה במטופל ההוא מבית המרקחת שדחף אותך לעבור למחקר?
"מעבר לקשר האישי, למטופל ההוא היה סרטן מסוג שנחשב כזה שאפשר להתמודד איתו, ולא מהקטלניים שלא משנה מה ייעשה, אין סיכוי לעזור לו. ולכן היה לי עצוב לראות אותו במצבו, בידיעה שכל זה היה נמנע אם הוא היה מאובחן קודם, ולא בשלב מתקדם עם גרורות. הרגשתי חסרת אונים שאין לי כל כך איך לעזור לו".
איך מגיעה רוקחת לפיתוח שבבים במחקר סרטן?
"זה אכן מעבר לא טריוויאלי", מסבירה פרופ' בני, ראש המעבדה לננו־רפואה בבית ספר לרוקחות בפקולטה לרפואה באוניברסיטה העברית והמנחה של שטיינברג. "אליענה נמצאת במסלול מצוינות של ננוטכנולוגיה, שאחת מהחוזקות שלו היא שהוא חושף את הסטודנטים להרבה מאוד דיסציפלינות שקשורות לחומרים ולהנדסה. אבל המקרה שלה הוא הרבה מעבר לזה — מדובר בבחורה נחושה ויצירתית. אם משהו לא עובד, היא תמצא את הדרך לגרום לו לעבוד. אם סוגרים לה דלת, היא נכנסת דרך החלון. זה משהו שלא כל סטודנט יודע לעשות. והיא ממזגת את הבסיס הטוב והחשוב של הרוקחות עם התחום ההנדסי והידע בעיצוב גרפי בתלת־מימד שהיא רכשה. השמים הם הגבול עבורה".
"זו בהחלט אחריות כבדה להמליץ לחולה במחלה סופנית באיזה טיפול לבחור", אומרת שטיינברג. "לפעמים אני קצת חוששת לשאול את הרופאים אם הצלחנו בסוף. הדאגה לאדם שמאחורי הניסוי נוכחת תמיד"
שטיינברג הצטרפה למעבדה של בני באוקטובר 2018, כשנה לאחר שהמעבדה החלה לפתח איבר על שבב, ותרמה לדחיפה משמעותית של המחקר. "הטכנולוגיה שלי מאפשרת להתאים את גודל השבב בדיוק לכמות הרקמות שאני רוצה לבחון, ולכמות הכימותרפיות שאני צריכה לבדוק בשילובים וריכוזים שונים", היא מסבירה, "זו שיטה נוחה מאוד שמותאמת בדיוק לכל ניסוי".
גם אופן יצירת הספרואידים — אותן רקמות משוחזרות שמיוצרות במעבדה מכל תא סרטני שנדגם מהמטופל — אינו מובן מאליו. "את הספרואידים, שנוצרים בדרך כלל בתוך יום אחד, יש אפשרות לייצר בתוך השבב או להכניס אותם לשבב מבחוץ", מסבירה בני. "המבנה של השבב שפיתחנו והחומרים גורמים לתאים הסרטניים להעדיף להיצמד אחד לשני במקום להתפרס על משטח, ולכן הם מייצרים באופן אוטונומי מבנה כדורי תלת־ממדי, במקום המבנה של תאים על משטח שנפוץ בניסויים. זה הבדל קריטי, משום שבמבנה הכדורי הם מתחילים להתנהג בדומה לאיך שמתנהגים תאים סרטניים בגוף מבחינת חילוף חומרים, חמצון ועוד".
השבב של שטיינברג היה צריך להתגבר על כמה מכשולים טכניים משמעותיים בדרך. "היה חשש שהשבב יהיה רעיל לתאים, כי הוא עשוי מפלסטיק ועלול להפריש חומרים רעילים לתאים, אז הפרוטוקול שלי גורם לחומרים להיות לא רעילים", מסבירה שטיינברג. "נוסף על כך, היינו צריכים לדאוג שהשבב יהיה שקוף כדי שיהיה אפשר לצלם אותו במיקרוסקופ, למצוא דרך לפתוח ולהוציא את הגידול בקלות מהשבב בלי שיהיו דליפות, ולאפשר לגדל את התאים למשך זמן בתוכו. לבסוף הצלחתי לפתח טכנולוגיה שמאפשרת את כל התכונות האלה וגם להדפיס את השבב במדפסת תלת־ממד במהירות, בתוך שעתיים".
איך רוקחת יודעת לעצב שבב שמדפיסים במדפסת תלת ממד?
"למדתי לבד. לא היה בלימודים קורס עיצוב, אז דוקטורנט אחר במעבדה, שמתמחה בהדפסות תלת־ממד, הכניס אותי לעולם הזה. אני מרגישה שזכיתי כי אני נהנית לעצב, אוהבת את החשיבה היצירתית, את האתגר להתגבר על מגבלות המדפסת ומגבלות השבב, ואת ההתמודדות עם כל מה שצריך כדי להשיג את המטרה. מכיוון שהשבב מותאם אישית אני צריכה בכל פעם לחשוב על עיצוב שונה בהתאם לצרכי המחקר".
את גורמת לזה להישמע פשוט, אבל זה ממש מורכב למי שלא בא מתחום ההנדסה.
"למי שמגיע מהנדסה קל יותר רק מהבחינה שהוא יודע להשתמש בתוכנה — דבר שלי לקח בהתחלה שעות. אבל עדיין היה חסר לאותו מהנדס הרקע בביולוגיה ובעיקר ההבנה מה הרקמה החיה צריכה. כך שבכל מקרה פיתוח השבב מצריך מבט לשני העולמות, גם הנדסה וגם ביולוגיה".
"אחד החסרונות בבדיקות הקיימות הוא שהן מצריכות דגימת חומר רב מגוף החולה", מסבירה פרופ' בני. "לעומת זאת לנו מספיקה כמות מאוד קטנה של רקמה כדי לבחון עשרות תרופות בזמן קצר. זה גיים צ'יינג'ר"

פרופ' בני. "אליענה נחושה ויצירתית, ותמיד תמצא דרך לגרום לדבר לעבוד"

פרופ' אורן. "לאחר שתוכח יעילותו, לשבב תהיה השפעה מרחיקת לכת". צילומים: יורם אשהיים, באדיבות האקדמיה הלאומית למדע
מבית המרקחת לחלל החיצון
למרות תאוצתו המחקרית, התחום "איבר על שבב" עדיין נמצא רק בתחילת דרכו המסחרית: יש חברות אחדות בשוק (ובראשן Mimetas ההולנדית ו־Beonchip הספרדית, לצד Tissue Dynamics הישראלית של פרופ' יעקב נחמיאס).
"אחד החסרונות בטכנולוגיות המתחרות הוא שהן מצריכות דגימה של די הרבה חומר מהגידול של החולה", מסבירה בני. "בשיטה שלנו מקסמנו את השטח, כלומר אנחנו מסוגלים להשתמש בכמות קטנה מאוד של רקמה בצורה יעילה מאוד, ואנחנו יכולות לנסות מקסימום תרופות על הכמות הקטנה הזאת. יש לנו גם יתרון של אנליזה דינמית, כלומר אנחנו מסוגלות להסתכל על רקמות ולעשות עליהן אנליזה בנקודות זמן שונות, ויש לזה משמעות גדולה בבחינה של איך החולה מגיב לתרופות. אנחנו גם יכולות לשחק עם העיצובים בהתאם לצורך המחקרי — ההדפסה במעבדה מאפשרת לנו שליטה בצורות גיאומטריות, מה שאחרים לא הצליחו לעשות בשיטות הסטנדרטיות".
את מתארת פה פריצת דרך.
"זו בהחלט פריצת דרך טכנולוגית, שיכולה להיות גיים צ'יינג'ר בתחום. זה תחום צפוף, ויש הרבה מחקרי 'איבר על שבב', אבל יש לנו הרבה יתרונות ייחודיים, כך שאנחנו בהחלט אופטימיות שהפיתוח שלנו ייתן דחיפה לתחום חיזוי התרופות".
השבבים המהפכניים נמצאים כעת בשלב הוולידציה, לאחר שבחנו עד כה כ־30 גידולים של מטופלים אונקולוגיים מבית החולים הדסה. "אנחנו ממשיכים כל הזמן לשכלל את המערכת ולהפוך אותה למתוחכמת עוד יותר", אומרת שטיינברג.
מה צריך עוד לשפר?
"בעיקר לגרום לשבב להיות עוד יותר מהיר, כלומר לרדת משבועיים לשבוע. בשביל זה צריך להיכנס לאלקטרוכימיה ולהתאים את המודל כך שיהיה עם כמה שיותר מדדים מדויקים מכל מיני כיוונים".
המטופלים ששטיינברג עובדת איתם בשלב זה הם חולי סרטן בשלבים מתקדמים, כאלה שסיכויי ההישרדות שלהם נמוכים. ולכן הניסויים שלה בודקים כרגע בעיקר יכולות בלימה או האטה של הגידול. אחד המטופלים האלה היה ילד בן 8. "קשה להפריד את החלק המדעי הטהור מהרגשות במקרה כזה", היא מספרת. "הגיעה אליי רקמת גידול של גליובלסטומה, הסרטן הכי אלים ואגרסיבי של המוח, שהתפתח אצלו. אז הרופאים מנסים לעשות כל מה שאפשר, ושלחו דגימות מהגידול למעבדות שונות, כולל אלינו. ובזמן שהם עוד חיכו לשמוע תוצאות מהמעבדות האחרות, אנחנו כבר הצלחנו גם לגדל את התאים וגם לזהות לאילו טיפולים הם הגיבו ובפני מה היו עמידים".
במקרה אחר בדיקה של ספרואידים שפותחו מדגימת גליובלסטומה של מטופלת זיהתה מוטציה ב־70% מהם, שלא זוהתה בגידול המקורי כלל. "זה לא שבגידול המקורי לא היתה המוטציה בכלל, כי היא לא נוצרת פתאום בתוך 20 יום", אומר ד"ר שי רוזנברג, רופא חוקר בתחום הנוירואונקולוגיה בבית החולים הדסה עין כרם. "היא פשוט היתה במיעוט זניח של תאי הגידול והטכנולוגיה סייעה לאבחן אותה. בהתאם המלצנו על תרופה שמטפלת במוטציה הזאת ועושה פלאים. המטופלת אמנם כבר היתה בשלב מאוחר של המחלה וחיה רק חודשיים נוספים, אבל הצלחנו לתת לה הקלה מסוימת". שטיינברג ורוזנברג הציגו את המקרה בכנס Society for Neuro-Oncology, הכנס המדעי החשוב בעולם בתחום גידולי המוח.
זו אחריות עצומה על הכתפיים שלך — לקבוע מה יכול להציל חולה במחלה סופנית.
"אני בהחלט מרגישה את כובד האחריות", אומרת שטיינברג. "ולפעמים אפילו קצת חוששת לשמוע מהרופאים את התשובה אם הצלחנו או לא. הדאגה לאדם שמאחורי הניסוי נוכחת כל הזמן. שמחתי מאוד שהצלחנו לעזור איכשהו למטופלת ההיא. זה מאוד משמעותי עבורי".
בדצמבר האחרון השבבים של שטיינברג הגיעו אפילו לחלל החיצון: ספרואידים שפיתחה במעבדה לתחנת החלל הבינלאומית שוגרו במסגרת פרויקט של SpacePharma כדי לבחון את השפעת התרופה דוקסיל על תאי סרטן בתנאי אפס כבידה. "רפואת חלל היא תחום מחקר צעיר וממש מעניין", אומרת שטיינברג. "הרעיון הכללי הוא שלאור ההתערבות האנושית ההולכת וגוברת בחלל וטרנד תיירות החלל, אין מנוס מכך שבסופו של דבר יהיה גם סרטן בחלל, ולכן רוצים לבחון כיצד כל התהליכים האלה קורים במיקרוגרביטציה — אם הם משפיעים על מהלך המחלה והטיפול בה".
התחלת בבית מרקחת והגעת עד החלל. הספק מרשים מאוד לגיל 28.
"עם כל הכבוד לכל הדברים המעניינים והמאתגרים שעברתי בתהליך, בסופו של דבר המטרה שלי תמיד היתה לעזור לאנשים. אני ממש מחכה שהשבב שלנו יהיה נחלת הכלל. זה יהיה מדהים".