ריסטארט לאנטיביוטיקה
יותר מ־30 שנה אחרי שנתגלתה האנטיביוטיקה האחרונה ורגע אחרי שארגוני הבריאות הכריזו כי נכנסנו לעידן החיידקים העמידים, גילו מדענים ב־MIT אנטיביוטיקה חדשה וחזקה במיוחד. בראש המחקר פורץ הדרך שמסעיר את הקהילה המדעית עומדת לא רופאה, כימאית או ביולוגית, אלא מדענית מחשב ישראלית. בשיחה מסבירה פרופ' רגינה ברזילי איך מייצרים "אינטואיציה של מכונה", ואיך אלגוריתם יכול להציל את האנושות, אולי גם מקורונה

תודה לאלגוריתם
ויקי אוסלנדר

ברזילי במשרדה ב־MIT. "לאורך כל הקריירה שלי תכננתי לחזור לישראל, אבל אז החיים קרו" צילום: John D. & Catherine T. MacArthur Foundation
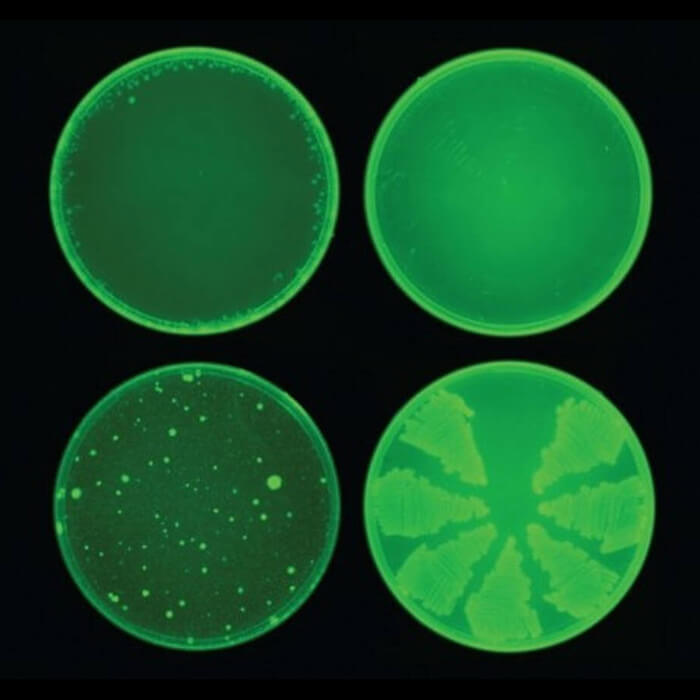
"התרגשות" היא לא מילה שאופיינית למסמכים מדעיים. ובכל זאת המאמר שפרסם בפברואר צוות חוקרים מ־MIT בכתב העת הנחשב "Cell" כלל אותה בחמישה מקרים שונים. יש לכך סיבה טובה מאוד: לראשונה זה יותר מ־30 שנה איתר הצוות מולקולה אנטיביוטית חדשה וחזקה במיוחד בשם הליצין (Halicin), שהצליחה להרוג שניים מהחיידקים העמידים והמסוכנים ביותר (מסוג חיידקים אנטריים ואצינטובקטר באומני), ולא פותחה כלפיה עמידות, אפילו לא לאחר 30 יום טיפול רציף. בתקופה שהוגדרה בידי ארגוני הבריאות "עידן הפוסט־אנטיביוטיקה", שבו האנושות תיאלץ להתמודד עם חיידקים שפיתחו עמידות לתרופות המוכרות — התגלית של MIT היא לא פחות ממהפכה.
לכן מפתיע לגלות כי המדענית המובילה בצוות איננה כימאית, ביולוגית או רופאה, אלא מדענית מחשב, ואפילו ישראלית — פרופ' רגינה ברזילי. בהכשרתה ברזילי היא בכלל בלשנית חישובית, שמכהנת כחברת סגל בכיר ב־MIT, פרופסורית בבית הספר להנדסה ולמדעי המחשב. הצוות שבהובלתה ובהובלת הפרופ' להנדסה ביולוגית ג'יימס קולינס פיתח מערכת בינה מלאכותית, שסורקת ביעילות ומהירות מופתית ספרייה כימית עצומה של תרכובות ידועות ומחפשת מולקולות עם פוטנציאל להיות תרופה אנטיביוטית חדשה. ובחודש האחרון, בצו השעה, גויס הצוות למאבק במגפת הקורונה המשתוללת (ועל כך בהמשך).
"כשרוצים למצוא מולקולה טובה צריך להסתמך על אינטואיציה", מסבירה ברזילי כיצד מדעני מחשב מסייעים לעקוף את נקודות העיוורון של כימאים וביולוגים. "מרבית תרופות האנטיביוטיקה שאושרו בעשור האחרון היו דומות אחת לשנייה. כולן תאמו את האינטואיציה האנושית הנוגעת לשאלה 'מהם המבנים הנכונים שצריך לחפש כדי למצוא אנטיביוטיקה יעילה?'. וזו הסיבה לעלייה בעמידות לאנטיביוטיקה. לכן אנחנו הצענו לקחת אוסף גדול של מולקולות ולבדוק במעבדה איך כל אחת מהן מעכבת גדילה של פתוגן (מחולל זיהומים). המתודולוגיה שפיתחנו מאפשרת לבינה המלאכותית לתרגם את הזיקה בין התגובה הכימית לפעילות המעכבת, כך שברגע שהוא ייחשף למולקולה חדשה, שמעולם לא נתקל בה, הוא יוכל לחזות את פעילותה".
ענף התרופות יורה לעצמו ברגל
בגיל 50 ברזילי אינה עוד מדענית, אלא אחת המובילות בעולם בתחומה. באמתחתה שורה ארוכה של עיטורים ותארים השמורים לעילית המדעית, ובהם מלגת "הגאונים" היוקרתית מק'ארתור ב־2017, פרס CAREER הנחשב של קרן המדע הלאומית, פרס TR35 של MIT למובילי חדשנות מתחת לגיל 35 ומלגת הפקולטות של מיקרוסופט. לפני שנה היא אף הוכתרה כאחת ממאה המנהיגים המובילים לפיתוחי בינה מלאכותית בתחומי הרפואה בידי ארגון Deep Knowledge Analytics.
התגלית של הצוות של ברזילי היא הישג היסטורי: מאז 1987 לא נמצאה מולקולה אנטיביוטית ממשפחה חדשה, כלומר תרכובת שהורגת חיידקים בדרכים שאינן מוכרות. זה לא שאין תרופות חדשות, אלא שכולן מתבססות על אותן משפחות של מבנים מולקולריים. וזו בעיה גדולה בהתחשב בתכונה המטרידה של חיידקים — אבולוציה.

רוב תרופות האנטיביוטיקה שאושרו בעשור האחרון היו דומות. כולן תאמו את האינטואיציה האנושית לגבי המבנים שיש לחפש, ולכן יש עלייה בעמידות החיידקים. אנו הזנו למודל אוסף גדול של מולקולות מסוגים שונים, רק מקצתם אנטיביוטיים, כדי שהוא לא יפתח את אותה הטיה"
מאז התגלתה התרכובת מחסלת הזיהומים הראשונה — הפניצילין המפורסם — יותר ויותר חיידקים ונגיפים מפתחים עמידות לאנטיביוטיקה, והתוצאה היא "חיידקי־על" עמידים. ב־2016 פורסם הדו"ח המבהיל והמצוטט מכולם בנושא: דו"ח אוניל, שנכתב ביוזמת ממשלת בריטניה ואומץ כסטנדרט בידי האו"ם, העריך כי אם לא יתבצע שינוי מרחיק לכת שיטפל בבעיית העמידות המתגברת למוצרים אנטיביוטיים, ב־2050 יהרגו חיידקי־על 10 מיליון איש בשנה וימחקו בדרך (מהיום ועד אז) 100 טריליון דולר מהכלכלה העולמית. ובנובמבר האחרון הכריז המרכז למניעת מחלות ובקרתן בארצות הברית (CDC) כי נכנסנו לעידן "פוסט־אנטיביוטיקה".
אם זה לא גרוע מספיק, שוק התרופות המודרני מתוכנן באופן כזה שלא משתלם לעבוד על פיתוחים אנטיביוטיים חדשניים: כדי לפתח תרופה, לאשר ולשווק אותה, נדרשים בממוצע עשר שנים ומיליארד דולר. אבל כשאנטיביוטיקה חדשה מגיעה לשוק, הערך שלה נגזר מיעילותה ומכך שטרם התפתחה בפניה עמידות. הבעיה היא שאין כדאיות כלכלית לתועלת העמוקה הזאת לבריאות הציבור: בתי החולים לא רוצים לתת לחולים את האנטיביוטיקה החדשה והיקרה בהינתן חלופות זולות, וגם כשכבר נותנים אותה, הם עושים זאת רק לפרקי זמן קצרים וכמוצא אחרון, כשממש כלו כל הקיצין. תרופות למצבים כרוניים הן פשוט משתלמות יותר, ולפיתוח של אלו נדדו ההון האנושי והכלכלי בתעשייה.
איך המודל עובד
1
הזנת נתונים
החוקרים הזינו לאלגוריתם של בינה מלאכותית נתונים על 2,335 מולקולות מוכרות, טבעיות וסינתטיות
2
למידת מכונה
האלגוריתם למד את המבנים הקיימים ואת התגובות הכימיות שכל אחד מהם מעורר
3
הסקת מסקנות
האלגוריתם יצר מודל חיזוי לפונקציונליות של מולקולות על בסיס המבנה שלהן
4
סריקה
האלגוריתם סרק ספריית ענק עם 107 מיליון מולקולות שונות

5
תוצאה
האלגוריתם איתר מולקולות עם מבנים שונים מהאנטיביוטיקות המוכרות, שיכולות להיות בעלות תכונות אנטי־בקטריאליות חזקות

6
הגביע הקדוש
החוקרים בחנו את המולקולות במעבדה ומצאו שאחת מהן - הליצין - יעילה נגד כמה חיידקים מסוכנים ועמידים
עד כמה השוק שבור? באפריל אשתקד הכריזה על פשיטת רגל אקאוגן (Achaogen), חברת אנטיביוטיקה שקמה ב־2002 ותרופה חדשה שלה אושרה רק כמה חודשים קודם לכן — משאלת לב של כל חברת תרופות. אלא שבמקום לשגשג, השוק הפיל את מניית החברה ואקאוגן הצליחה למכור תרופות במיליון דולר בלבד — סכום זניח ביחס להשקעה. זמן לא רב לפניה אמרה נואש גם מלינטה תרפיוטיקס, שלא הצליחה להרוויח מארבע תרופות אנטיביוטיות שפיתחה. שתי חברות "בוטיק" אלו מצטרפות לחמש חברות תרופות גדולות שפעלו בתחום וסגרו את כל המחקרים שלהן בשנים 2017–2018, והביאו את ארגון הבריאות העולמי להפיץ בינואר האחרון "אזהרה חמורה" כלשונו, על השבר העמוק בשוק שיהיה בכייה לדורות: "הרוב המכריע של 60 המוצרים החדשים בפיתוח בעולם כולו הם וריאציות לטיפולים קיימים".
"הקורונה הבהירה עד כמה נחוץ פתרון זריז כמו שלנו"
את החלל המסוכן הזה שנפער — בין צורכי האוכלוסייה לכדאיות הכלכלית של חברות מסחריות — מנסה הצוות של ברזילי למלא. "לחברות לא משתלם לפתח את התרופה, אבל אנחנו יכולים לעשות זאת", אומרת ברזילי. "משבר הקורונה הדגיש עד כמה יש צורך במגוון פתרונות חדשניים. יש מבחנים קליניים רבים שמתקיימים כעת בלי שיש בידי החוקרים אפילו את הקומבינציה הרצויה לטיפול, יש הרבה מאוד תופעות לוואי שאין לנו פתרון עבורן. וזאת למרות המון המשאבים והמאמצים האדירים שמושקעים בנושא כבר כמה חודשים. אנחנו חייבים להיות מהירים יותר בפיתוח תרופה חדשה, ואחת הדרכים לכך היא למצוא את הפתרון בתרופות קיימות או בקומבינציה של תרופות קיימות".

האל, המחשב הרצחני מ"אודיסיאה בחלל" שנתן השראה להליצין, האנטיתזה שלו. צילום: Warner Bros
למה צריך לעשות תחזיות של מולקולות, אם במשך כמה שבועות אפשר פשוט לבדוק את כל המולקולות?
"כי אנחנו לא מחפשים רק מולקולות, אלא גם תרכובות שלהן. מה שנמצא יעיל לטיפול ב־HIV, למשל, הוא לא תרופה אחת, אלא קומבינציה — ואת אלו אי אפשר לסרוק בקלות. את יכולה לבחון 25 אלף מולקולות בכמה שבועות, אבל לא 25 אלף מולקולות במכפיל של 25 אלף מולקולות, כדי למצוא את השילוב הטוב ביותר. וזה מה שאנחנו מחפשים, את המודל שיוכל לנבא איזה שילוב ואיזו תרכובת יכולים להביא לתגובה הטובה ביותר.
"המודלים הנוכחיים יודעים לקטלג את המולקולות לפי מאפיינים טוב יותר וללא הצורך באדם שיכוון לאילו מאפיינים יש לשים לב", מוסיפה ברזילי. "השיטה הזו מהירה וזולה הרבה יותר כשמנסים לבחון שטחים רחבים של תרכובות כימיות. היא במקביל גם שומרת על אג'נדה מתוחכמת, שכוללת חיפוש אחרי מבנים שיהרגו רק חיידקים ספציפיים ולא שום דבר אחר".
2,335 תרכובות שונות שימשו את הצוות של ברזילי בלימוד המערכת הממוחשבת (שמכונה "רשת עצבית" משום שהארכיטקטורה שלה נוצרה בהשראת הנוירונים המחוברים זה לזה במוח). כל חומר נבדק על חיידקים כדי לאבחן כיצד הגיבו לו. לאחר שלמד את התרופות הקיימות, המחשב סרק מאגרים עצומים חדשים של מולקולות — מגוון רחב של תרופות, חומרים סינתטיים וטבעיים שונים — כדי לאתר כל תרכובת שתעכב את התפתחות החיידק אי.קולי, שעליו נערך המחקר. ומשום שרק חלק קטן ממאגר האימונים היו תרכובות אנטיביוטיות, הרשת עצמה לא פיתחה דעה קדומה או הטיה לגבי איך צריכה להיראות מולקולה אנטיביוטית. כל שהיא חיפשה היה מולקולה אחת קסומה עם מנגנון פעולה לא שגרתי, שיאפשר לה להילחם בזיהומים עמידים לתרופות רבות.
מקרב המולקולות זיהתה הרשת העצבית 120 מולקולות מבטיחות, שתויגו על ידה "להיט". ברזילי והצוות סיננו ידנית כל אחת שנראתה יותר מדי כמו "אנטיביוטיקה" מוכרת או היתה חומר שידוע כרעיל. מתוך 23 מולקולות שנותרו להם ונבדקו במעבדה אותרה אחת יוצאת דופן שמנגנון הפעולה שלה פגע במטבוליזם של החיידקים, אך כימאים לא חשבו עליו עד אותו הרגע.
את המולקולה המהפכנית שמצא המודל כינו החוקרים "הליצין", כהומאז' ל"האל", הבינה המלאכותית הרצחנית מהסרט "2001: אודיסיאה בחלל". "הליצין הוא האנטיתזה של האל, הוא הבינה המלאכותית הטובה שמצילה את בני האדם", אומר ל"מוסף כלכליסט" ד"ר ג'ון סטוקס, המחבר הראשון שחתום על המחקר.
"גיליתי שלמידת מכונה לא חדרה למחקר הכימי"
ברזילי נולדה בקישינב, מולדובה, ועלתה לארץ בגיל 20. היא התמקמה עם הוריה ברחובות, והשלימה תואר ראשון (1993) ושני (1998) במדעי המחשב באוניברסיטת בן גוריון. מיד אחר כך עברה לניו יורק כדי להשלים דוקטורט באוניברסיטת קולומביה.
ברזילי היתה בטוחה שההרפתקה שלה בארצות הברית תהיה מוגבלת בזמן, והיא תשוב במהרה לישראל. אבל מקולומביה היא עברה לפוסט־דוקטורט באוניברסיטת קורנל ומשם הגיעה ב־2003 ל־MIT, האוניברסיטה שבה היא משמשת עד היום פרופסורית במחלקה למדעי המחשב. "לאורך כל הקריירה שלי תכננתי לחזור לישראל, אבל אז החיים קרו", היא מספרת. "מרבית המחקר שלי הוא בפארמה ואף שהרבה מאוד מחקר ניתן לעשות היטב בישראל, כמו בקיימברידג', יש דברים שניתן לעשות טוב יותר כאן, משום שאני מוקפת בכל חברות התרופות שאיתן אנחנו משתפים פעולה.
עוד במוסף כלכליסט
"ובכל זאת, אני רואה את עצמי מדענית ישראלית שנכון להיום מכהנת כפרופסורית ב־MIT. אני מבקרת כל הזמן בישראל וההורים שלי מבקרים אותי כאן. מאוד קשה עכשיו כשאי אפשר לטוס. אני אפילו משתפת פעולה באופן אקטיבי עם אוניברסיטת תל אביב ושומרת על הקשר חי. למולדובה, לעומת זאת, מעולם לא חזרתי אפילו לביקור".
במשך השנים עסקה ברזילי במחקרים הקשורים לעיבוד שפה טבעית, עד שב־2016 הוצע לה להצטרף למחקר במחלקת ההנדסה הכימית בארגון הצבאי המחקרי DARPA. "הם היו צריכים מומחית ללמידת מכונה", היא מסבירה. "בזמנו כמעט שלא היה מחקר בתחום, ורציתי להבין מה זה. גיליתי המון אפשרויות. בשנתיים הראשונות למדתי איך מעצבים מולקולות, ומהן הדרכים האפקטיביות ביותר לעצב אותן בלי בכלל לחשוב על תעשיית הפארמה. בשלב מסוים הסתכלתי מחוץ לחלון המשרד שלי ב־MIT וראיתי את הלוגואים של נוברטיס ואמג'ן, שתי ענקיות פארמה, ותהיתי מה הן עושות, איך הן פותרות את הבעיות האלו? הזמנו אותן וגילינו שהן כלל לא משתמשות בטכנולוגיה, שלמידת מכונה כלל לא חדרה לתחום של התגליות הכימיות".
כדי לפתח תרופה, לאשר ולשווק אותה נדרשים כעשר שנים ומיליארד דולר. אבל כשהיא תגיע לשוק, בתי החולים ייתנו אותה רק כמוצא אחרון ויתעדפו חלופות זולות קיימות. לכן כל כך הרבה חברות קורסות. כאן נכנסת ברזילי לפעולה: "אנחנו יכולים לעשות מה שלחברה מסחרית לא משתלם"

סטוקס. "הליצין הוא ה־AI שמציל את האדם"
במשך השנים הצליחו כמה חברות למנף את כלי הבינה המלאכותית שפותחו ב־MIT לתגליות שונות, אבל זה לא היה מספיק. "הבעיה שהיתה לי היא שלא ראיתי את התהליך בשלמותו. היינו נותנים את הכלי, החברות היו משתמשות בו, ולא ידעתי מה קורה בין לבין. אז חיפשתי שיתוף פעולה בתוך האוניברסיטה שיסגור את המעגל, שאוכל לראות את כל השלבים מבפנים. למזלי התחברתי עם פרופ' ג'יימס קולינס (חלוץ בתחום הביולוגיה הסינתטית. זוכה מלגות רודס ומק'ארתור, ו"א), שעובד על פיתוחים אנטיביוטיים, ולפני כמה חודשים התחלנו לעבוד יחד".
התוצאה היה הליצין, שגילויו מכה כעת גלים. וולטר ריד, המתקן הרפואי הצבאי החשוב ביותר של ארצות הברית, הודיע שייקח את המחקר לשלבים קליניים מתקדמים, הכוללים ניסויים על בעלי חיים ובתקווה אף ליותר מכך. "התחום של תגליות כימיות ובינה מלאכותית הוא נהדר, ולמידת מכונה יכולה לשנות אותו לחלוטין. המצב הנוכחי של המגפה מראה לנו עד כמה התחום הזה נואש כשאין לנו את התרופה הנכונה. קשה להאמין שהקורונה תהיה המגפה האחרונה, ואנחנו חייבים לייצר מנגנונים שיכולים לעצב מולקולות חדשות על פי דרישה".
"חייבים שיתוף מידע כדי לנצח את הקורונה"
בחודש האחרון, בעודנו סגורים בבתים והמסדרונות ב־MIT ריקים, הצוות של ברזילי וקולינס עובד במרץ על מציאת תרופה לנגיף הקורונה. ימים אחדים יכולים לעשות הבדל משמעותי בנוגע להתקדמות המחקר בטיפול בנגיף. "אחת הסיבות לכך שיכולנו לבצע את הניסוי האנטיבקטריאלי בקלות כה גדולה, היתה משום שיש לנו מישהו ב־MIT שיכול לנסות תרכובות שונות על תאים אנושיים, לבחון עליהם מי נדבק ומי לא. את המידע הזה שנוצר בתוך האוניברסיטה עצמה מינפנו כדי לאמן את המודל, שאחר כך הפעלנו על מיליוני מולקולות אחרות כדי למצוא מאגר קטן של מולקולות מבטיחות.

קולינס. ברזילי הביאה את הידע החישובי, הוא את הביולוגי
"הבעיה עם נגיף הקורונה היא שלא יכולנו לבצע את הסריקה ב־MIT, כי יש צורך בבידוד ביטחוני מיוחד כדי לעבוד עם הווירוס הזה בבטחה, ושלא היה מידע נגיש כלל כדי לאמן את המערכת והמודל שלנו. "אבל בשבוע האחרון כמה קבוצות שחררו חלקיקי מידע, שאותם שילבנו עם מה שאנחנו יודעים על 50 התרופות שנמצאות בבדיקה לנגיף ומידע בנוגע לסארס־1. פיתחנו כמה מתודולוגיות שאפשרו לנו לאחד את מקבצי המידע האלו יחדיו, ויצרנו מודל שירוץ ויחפש את המולקולה שאולי תוכל להתמודד עם הנגיף. גם כאן וולטר ריד יבחנו את המולקולה שהמודל שלנו יציע".
למה אתם נאלצים לאסוף שברירי מידע ממקורות רבים אם המגפה משתוללת בפראות כבר כמה חודשים?
"מכמה סיבות. ראשית, לקח זמן עד שניסחו את הסריקה שיכולה למדוד במדויק את מעכבי הווירוס, ושנית יש גם מידע רב שרואים בו זכויות קניין. אנשים מנסים לשתף פעולה, במיוחד מוסדות אקדמיים שהופכים הכל לציבורי, אבל הרבה מאוד מהמידע שיכול להיות שימושי — בעיקר זה שאצל חברות תרופות — חוסה תחת זכויות קניין. צריך להיות מנגנון כלשהו שייצר נתיב שדרכו כולם ירגישו בנוח לשתף מידע.
"אני קצת מופתעת שבזמן שמניין ההרוגים מנגיף הקורונה רק ממשיך לעלות, אנחנו לא רואים יותר שיתופי פעולה כאלו. תחשבו על זה, יש מידע שנאסף בסין, באיטליה ובאזורים אחרים שבהם הכתה המגפה קשה, אבל מעט מאוד מהמידע הזה — שיכול להעניק הרבה מאוד תובנות מעמיקות לאנשים מבחוץ — נגיש לנו. כמובן יש שיקולי פרטיות ואני מאמינה שלאנשים יש כוונות טובות, אבל אנחנו נמצאים במצב חסר תקדים. חייבים לשתף כמה שיותר מידע כדי שכולנו נוכל ללמוד ממנו, וכך יחד נוכל למצוא בהקדם פתרון שיעזור לכולם".





























